حدد مجلس الوزراء 128 شرطاً لتنظيم وتشغيل وضمان الجودة ومراقبة العمليات في مراكز تخزين دم حبل السرة والخلايا الجذعية.
وألزمت بنود قرار مجلس الوزراء رقم (6) لسنة 2020، الذي حصلت «الرؤية» على نسخة منه، المراكز العاملة بهذا التخصص، حكومية وخاصة، بتوفيق أوضاعها وفق ما يتلاءم مع أحكامه خلال 6 أشهر من تاريخ العمل به.
وأوضحت البنود أن العمل به يبدأ بعد 6 أشهر من تاريخ نشره في الجريدة الرسمية، ويستثنى من هذه الضوابط، الأنسجة الجينية، والخلايا الجذعية الجينية، والدم ومشتقاته (ما عدا الخلايا الجذعية المكونة للدم)، والخلايا التناسلية (البويضات والحيوانات المنوية)، والأعضاء البشرية.
ونصت متطلبات الترخيص للمنشآت، على أن يتم تقديم الطلب مرفقاً مع المستندات المطلوبة للجهة الصحية المعنية، على أن ترسله الجهة المعنية إلى اللجنة العليا لدم حبل السرة والخلايا الجذعية، على أن تتم كل هذه الإجراءات بما فيها الموافقة أو الرفض خلال شهر واحد.
تضمنت المستندات المطلوبة للترخيص، صورة ضوئية لجواز سفر المالك والشريك (إن وُجِد)، وبطاقة الهوية الإماراتية للمالك وتوقيع معتمد له، وموافقة دائرة التنمية الاقتصادية على اسم المنشأة الصحية، وعرضاً تقديمياً حول المشروع، مرفقة معه المعلومات العلمية ومدعوماً بالمراجع والأبحاث، والمخطط الهندسي المقترح، وموقع الأرض، وخطة المنشأة حول الأهداف، ونطاق التنفيذ، والهيكل التنظيمي، والسياسة الإدارية، والموظفين، وسياسة عملية المراقبة، وسياسة الإخطار بحدوث مضاعفات سلبية.. وغيرها.
كما يتعين على مقدم طلب الترخيص تقديم ضمان مصرفي بقيمة 10 ملايين درهم، وفي حالة ارتكاب مخالفة من قبل المنشأة المرخصة، يتم خصم مبلغ يتناسب مع طبيعة المخالفة من هذا الضمان، على أن يتم إعادة المبلغ المخصوم جراء المخالفة إلى رصيد الضمان البنكي من قبل المنشأة المرخصة في مدة لا تتجاوز شهرين من تاريخ الخصم.
وألزم القرار المنشآت المرخصة بالسماح لمفتشي الجهة الصحية المعنية بممارسة دورها الرقابي على المنشأة ومرافقها ومعداتها ومنتجاتها، ويجوز أن يتم التفتيش بإشعار مسبق أو دون إشعار، ويعتمد تكرار التفتيش على سجل الامتثال للمنشأة، ومن حق المفتش مراجعة أي سجلات والحصول منها على نسخ، ويحظر نسخ أي سجلات دون إخفاء هوية اسم المتبرع والمتلقي.
تضمنت شروط التنظيم والتشغيل وجوب الفحص والتقييم الدقيق للمتبرع، واختبار الخلايا المنقولة بأفضل الوسائل العلمية المتاحة، تفادياً للإصابة بالأمراض نتيجة عملية زرع الخلايا المكونة للدم، وأكد القرار أن التبرعات طوعية وغير مدفوعة الأجر. ونص القرار على وجوب أن يكون لدى المنشأة نظام اعتماد المنشآت للعلاج الخلوي، ونظام للإبلاغ عن أي مضاعفات تتعلق باستجلاب واختبار ومعالجة وحفظ وتخزين وتوزيع دم حبل السرة والخلايا الجذعية، ووجوب تزويد المتبرعين المحتملين بدم حبل السرة بكل الضمانات حول سرية المعلومات ونتائج الاختبارات التي أجريت على الخلايا المأخوذة منهم.
ويتعين على الجهات الصحية التأكد من أن الدم والخلايا الجذعية المنقولة أو المعالجة أو المخزنة أو الموزعة، يمكن تتبعها، وتكون عملية التتبع ممكنة من الفحص الدقيق للمادة والمتبرع والمنشأة المشرفة على النقل، وإجراء تحديد هوية المختبرات ونظام وضع العلامات ومراجعة السجلات.
وألزم القرار المنشآت التي تعمل في المجال بالحصول على اعتماد لأنشطتها من منظمة معتمدة ومعترف بها دولياً خلال عامين من تاريخ بدء العمل، وفي حالة عدم الحصول على الاعتماد أو تجديده تمنح المنشأة 6 أشهر، وبعدها يحق للجهة الصحية إغلاق المنشأة.
ويتعين على المنشأة المرخصة أن تضمن وجود نظام للإبلاغ والتحقيق والتسجيل ونقل المعلومات عند حدوث أية مضاعفات خطرة أو ردود أفعال سلبية من شأنها التأثير على جودة وسلامة الخلايا، والتي قد تحدث بسبب خطأ في عملية نقل أو اختبار أو معالجة أو تخزين دم حبل السرة والخلايا الجذعية، والإبلاغ عن هذه الأمور إذا حدثت أثناء أو بعد الزراعة.
ولا يصرح بإجراء عملية نقل دم حبل السرة والخلايا الجذعية إلا بعد اتخاذ كل الإجراءات الضرورية للتأكد من إلمام المتبرع أو أقربائه أو المفوض عنه بمعلومات العملية وموافقته عليها، مع الحفاظ على سرية المعلومات، وأن تكون مؤمّنة بحيث لا يتم إجراء أي حذف أو تغيير أو نقل أو إضافات غير مصرح بها.
ويجب إدراج الكواشف الكيميائية والمواد اللازمة للحفاظ على خصائص الجودة الحرجة للخلايا في قائمة، وأن تخضع هذه الكواشف لضوابط القبول، كما ينبغي تحديد جميع المعدات الحرجة وخضوعها للضوابط المنصوص عليها في قسم المعدات، وأن تؤدي أي انحرافات عن خصائص الجودة إلى إجراء تحقيقات موثقة، والتي تتضمن إصدار قرار بخصوص الإجراءات التصحيحية والوقائية المحتملة، وينبغي تحديد مصير الخلايا غير المطابقة.
وشدد القرار على تحديد الظروف اللازمة للحفاظ على خصائص الخلايا المطلوبة وضبط حدود التحمل عند تخزينها، وضرورة تعيين مناطق التخزين لتجنب الاتصال الكيميائي أو الحد منه أو التعرض للغلاف الجوي أو أي مصادر محتملة لحدوث العدوى، مع تحديد إجراءات واحتياطات خاصة بهدف الحفاظ على ظروف التخزين.
وتضمنت الشروط موافقة الأم على التبرع بدم حبل السرة أثناء فترة الحمل أو بعد الولادة مباشرة، لتخزين دم حبل السرة الخاص بطفلها قصد استخدامه المحتمل في المستقبل، ويتم توفير المعلومات اللازمة للأم بلغتها التي تتحدث بها، مع موافقتها على استخدام هذه العينات في المختبر أو البحث العلمي عندما تكون الخلايا المأخوذة غير مناسبة للاستخدام السريري.
وأكد القرار على أن يُبنى معيار الاختبار للمتبرعين على أساس تحليل المخاطر المتعلقة باستخدام الخلايا المحددة، ويجب تحديد مؤشرات لتلك المخاطر عن طريق إجراء الاختبار البيولوجي واستعراض التاريخ الطبي والسلوكي والفحوص الطبية، مع وجوب الاحتفاظ بسجلات المتبرع في أرشيف المنشأة 30 سنة على الأقل بعد الاستخدام السريري.
بروتوكولات العينات
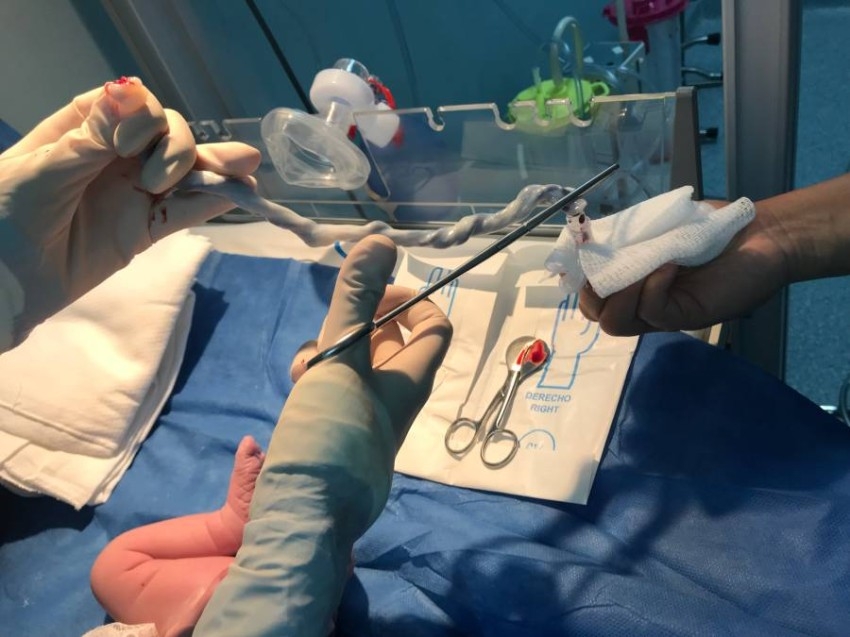
حددت الضوابط عدة إجراءات لأخذ العينات من دم حبل السرة ومعالجتها وتخزينها، بحيث يتم تصميم بروتوكولات خاصة لأخذ عينة من دم حبل السرة لتجنب التداخل مع عملية الولادة والمحافظة على التعقيم، ويجوز أخذ عينة دم حبل السرة قبل عملية إطلاق الولادة «داخل الرحم»، أو في أعقاب إطلاق المشيمة «خارج الرحم».
ويجوز أخذ مسحة من لعاب الطفل المولود من أجل فحص وجود الفيروس المضخم للخلايا CMV، ويتم الحصول على عينة دم من الأم خلال 7 أيام من جمع عينة دم حبل السرة لفحص العدوى التي يمكن أن تنتقل إلى الطفل.